Revisemos los símbolos, significados, interpretaciones y ejercicios más comunes.

Simbología
La nomenclatura atómica nos permite conocer (o informar), acerca de la composición de un átomo con respecto a las cantidades de sus partículas fundamentales más generales: protón, neutrón y electrón.
En muy poco espacio, la nomenclatura atómica nos informa sobre la cantidad de protones, neutrones y electrones que posee un átomo, y a la inversa, para informar la composición de un átomo en forma muy resumida, podemos escribir esta simbología considerando:

Símbolo del elemento
Dado que la identidad de un elemento depende de la cantidad de protones que tengan sus átomos en el núcleo, si conocemos el número atómico ( Z ) conoceremos también el símbolo del elemento, con ayuda de la tabla periódica.
En general, la tabla periódica está ordenada según el número atómico, en orden ascendente, de izquierda a derecha y de arriba hacia abajo.
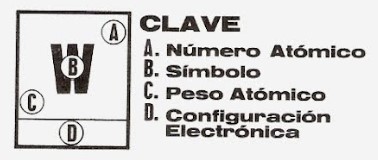
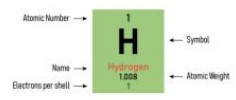
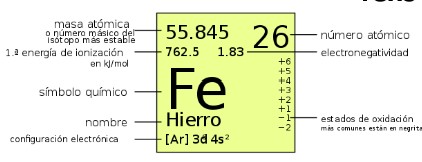
ADVERTENCIA: cada tabla periódica es diferente; la ubicación del número atómico alrededor del símbolo varía según el autor, por lo que antes de usar por primera vez una tabla, debemos ubicar su "leyenda" y distinguir la ubicación de cada tipo de información que provee.
Ejemplos de diferentes diseños de tablas periódicas, cada una con una "leyenda" diferente.
Número atómico
Indica la cantidad de protones que un átomo posee en el núcleo.
La identidad química de un átomo queda determinada por su número atómico.
(Chang, 2017)
Esta idea implica que:
La cantidad de protones en el núcleo indica el nombre del elemento al que pertenece el átomo.
Un átomo puede perder o ganar neutrones o electrones, y seguirá correspondiendo al mismo elemento al que pertenecía antes de los cambios.
El átomo de un elemento que pierde o gana protones, transmutará, o cambiará su identidad, transformándose en el átomo de otro elemento.
Este dato es directo; no necesita cálculos: el número atómico indica la cantidad de protones que un átomo posee en el núcleo.
Z: Número atómico = n° de protones
Número másico
Indica la cantidad de partículas presentes en el núcleo del átomo, es decir, la cantidad total de protones y neutrones del átomo.
A: Número másico = n° de protones + n° de neutrones
Número másico e Isótopos
Para un elemento, la cantidad de protones es fija, pero la cantidad de neutrones puede variar, por lo que un elemento podría estar formado por diferentes tipos de átomos, todos con la misma cantidad de protones, pero con distinto número másico. Estos átomos se denominan "isótopos".
Los isótopos del Carbono se diferencian sólo en la cantidad de neutrones que poseen

Número másico e Isóbaros
Es posible que átomos de diferentes elementos (con diferentes números atómicos) presenten el mismo número másico. A estos átomos se les denomina "Isóbaros".

Número másico e Isótonos
Por último, también es posible que un conjunto de átomos posean la misma cantidad de neutrones, pero con diferente número atómico y número másico. A estos átomos se les denomina "Isótonos".
Carga eléctrica
Informa sobre el balance de cargas eléctricas positivas y negativas dentro del átomo.
Se calcula como la resta entre protones y electrones.
C: Carga eléctrica = n° de protones - n° de electrones
ADVERTENCIA: Es un error muy común confundir el signo (-) de la resta con el signo (-) de la carga eléctrica del electrón, por lo que los estudiantes más impulsivos, mecánicos o descuidados tienden a pensar matemáticamente el valor de la carga eléctrica, lo que podría alterar el resultado de esta resta simple.
Ejemplo: 2 protones (positivos) menos 5 electrones (negativos): C= 2+ - 5-
... menos por menos, más ... (lógica matemática)
entonces C= 2 + 5 = 7
RECUERDE: las cantidades siempre son positivas; por lo que si tenemos 2 protones y 5 electrones, la diferencia o resta serán siempre 3 electrones. ( p+ - e- decir que hay "menos dos electrones" equivale a decir que "faltan" dos electrones.
Iones vs Átomos neutros
Si la cantidad de protones y electrones es igual, las cargas eléctricas se contrarrestan mutuamente y se dice que el átomo es " neutro ".

Si la cantidad de protones y electrones es diferente, una de las cargas eléctricas predomina y se dice que el átomo es un "ión".
Si las cargas positivas predominan (protones > electrones) el ión se denomina "Catión".

Si las cargas negativas predominan (protones < electrones) el ión se denomina "Anión".

Los átomos pueden ganar o perder electrones sin perder su identidad, pero su carga eléctrica cambiará.
EJERCICIOS DE APLICACIÓN
Utiliza los links proporcionados por tu profesor para ingresar a la plataforma de ejercitación.
IMPORTANTE
Si Ud es estudiante, recuerde inscribirse usando los 8 primeros dígitos de su RUN.
Ejemplo: si su RUN es 12.345.678-9
debe inscribirse como 12345678
Bibliografía
Chang, R. Goldsby, K. (2017). Química. 12a Ed. Mc Graw-Hill. México.
Whitten, K. Davis, R. Peck, M. Stanley, G. (2015). Química. 10a Ed. Cengage Learning. México.